편집자님께,
2형 당뇨병(T2D)은 일반적으로 말초 조직의 인슐린 저항성으로 시작하여 β세포 질량 감소 또는 β세포의 역분화로 인해 췌도 기능이 점진적으로 상실되면서 진행됩니다 .1 , 2 .30%가 넘는 2형 당뇨병 환자가 결국 외인성 인슐린 치료에 의존하게 됩니다.사체 췌도 이식은 인슐린 의존성 당뇨병에 효과적인 치료법입니다 .3 , 4 .특히, 췌도 이식 후 대사 조절이 개선되면 더 나은 신장 이식편 기능과 장기 생존율이 연관됩니다 .5 , 6 .그러나 췌도 이식의 적용은 기증 장기의 심각한 부족으로 인해 심각하게 방해를 받고 있습니다.
인간 다능성 줄기 세포(hPSC)에서 생성된 췌장 전구체(PP) 세포 또는 췌도 조직은 당뇨병 동물 모델에서 생존하고 기능하며 고혈당을 역전시키는 것으로 나타났습니다 .7 , 8 , 9. 또한 최근 임상 시험에서 T1D 환자에게 피하 이식했을 때 비면역보호 장치로 캡슐화된 hPSC 유래 췌장 내배엽 세포가 식사에 반응하는 β 유사 세포로 더욱 성숙하고 인슐린을 분비할 수 있었지만, 외인성 인슐린의 독립성을 달성하기에는 불충분한 수준이었습니다 .10 , 11. 그럼에도 불구하고 hPSC 유래 세포의 임상적 적용은 복잡한 분화 과정과 생체 내에서 기형종을 형성할 수 있는 잔류 미분화 세포 위험으로 인해 훼손됩니다. 최근 연구는 비종양원성 인간 내배엽 줄기세포(EnSC) 12 를 포함한 중간 줄기세포 유형을 식별하는 데 중점을 두고 있으며 , 이는 췌도 세포의 대량 생성을 위한 전구체로 더 적합한 것으로 보입니다.
여기서, 우리는 인슐린 분비가 손상된 T2D 환자에서 자가 EnSC로부터 체외에서 분화된 췌도 조직(E-췌도)의 간내 이식을 보고합니다. 이것은 인슐린 의존성 당뇨병 환자를 치료하기 위한 E-췌도의 안전성과 효능을 조사하기 위해 설계된 연구자 주도 시험의 파일럿 연구입니다(그림 1a ). 환자는 25년의 제2형 당뇨병 병력이 있는 59세 남성으로, 말기 당뇨 신병증이 발병하여 2017년 6월에 신장 이식을 받았고 2019년 11월부터 혈당 조절이 불량했으며, 혈당 수치가 3.66~14.60mmol/L, 평균 혈당 변동 폭(MAGE)이 5.54mmol/L, 목표 범위 내 시간(TITR, 3.9~7.8mM)이 56.7%, 일일 고혈당 사건(>10.0mmol/L)이 0.7회/일, 저혈당 사건(<3.9mmol/L)이 0.3회/일인 것이 특징이었습니다(보충 표 S1 ). 저혈당에 대한 주요 우려와 혈당 조절이 제대로 되지 않으면 기증 신장의 장기적 생존에 부정적인 영향을 미칠 수 있다는 점을 고려하여 환자는 자가 E-췌도 이식을 진행하기로 동의했습니다.
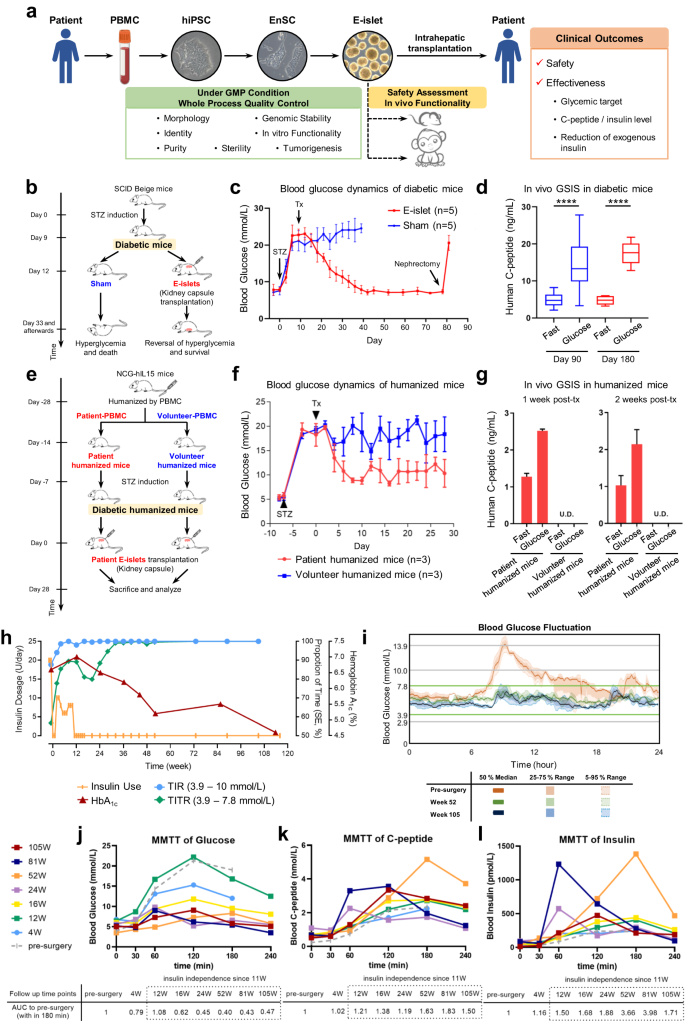
a E-섬의 생성 및 품질 관리와 E-섬 이식의 안전성/효과 평가에 관련된 주요 절차에 대한 간략한 개요.b – d E- 섬은 STZ로 유도된 당뇨 면역결핍 마우스에서 고혈당을 역전시킨다.E-섬의 신장 캡슐 이식에 대한 개략적 그림( b ).공복 혈당 역학(파란색 선: 가짜 그룹; 빨간색 선: E-섬 이식 그룹, c ).이식 후 90 일과 180일에 공복 후와 복강 내 포도당 볼러스 후 30분 후의 인간 C-펩타이드 분비( d ).e – g 인간화된 마우스에서 E-섬의 면역원성.환자와 자원자의 PBMC로 인간화된 NCG-hIL15 당뇨 마우스에 환자 특정 E-섬의 동종 및 이종 신장 캡슐 이식에 대한 개략적 그림( e ). 공복 혈당 역학(파란색 선은 자원 봉사자의 PBMC로 인간화된 3마리의 당뇨 마우스에 환자 E-섬을 이식한 대조군을 나타냄; 빨간색 선은 환자 PBMC로 인간화된 3마리의 당뇨 마우스에 환자 E-섬을 이식한 군을 나타냄, f ). E-섬 이식 후 7일과 14일에 공복 후와 복강 내 포도당 볼러스 후 30분 후에 분비된 인간 C-펩타이드(UD 미검출, g ). h 116주 동안 TITR, TIR 및 HbA1c의 임상 측정과 인슐린 투여량. i 수술 전 수치와 비교한 52주와 105주차의 CGM 측정에서 얻은 연속적인 간질성 포도당 변동. j – l MMTT 분석에서 얻은 공복 및 식사 자극 순환 포도당( j ), C-펩타이드( k ) 및 인슐린( l ) 의 혈청 수치 .
E-섬은 GMP 조건에서 두 가지 중간 단계를 거쳐 이전 보고서 12 에서 수정된 배양 조건에서 확립된 자가 EnSC에서 생성되었습니다 (자세한 내용은 보충 방법 참조).EnSC에서 유래한 PP, 내분비 전구 세포 및 E-섬의 형태, 순도, 생존력 및 미생물 오염은 방출 기준을 충족하는 것으로 입증되었습니다(보충 그림 S1 ~ S3 및 표 S6 ).E-섬은 인간 사체 섬과 유사한 형태(보충 그림 S3a ), 내분비 세포 구성(보충 그림 S3b, c, e, f ), 유전자 발현 패턴(보충 그림 S3d~f ) 및 시험관 내 기능(보충 그림 S3g )을 보였으며 스트렙토조토신(STZ)으로 유도한 당뇨병 마우스(그림 1b~d ) 및 원숭이(보충 그림 S4 ) 모델 에서 기능적 효능을 보였습니다 . scRNA-seq(보충 그림 S3f ) 또는 FACS(보충 그림 S3h )로 검사했을 때 비표적 간 또는 장 계통은 감지되지 않았습니다. 실험 중에 EnSC 또는 E-섬을 이식받은 면역 저하 동물에서는 종양 형성이나 세포 증식을 나타내는 낭포/관 구조가 감지되지 않았습니다(보충 표 S3 ). 환자 특이적 E-섬은 환자 자신의 PBMC로 인간화된 당뇨병 면역 저하 마우스의 신장 캡슐 아래에서 살아남아 기능했지만, 혈연이 없는 자원 봉사자의 PBMC로 인간화된 마우스에서는 거부되었습니다(그림 1e–g ; 보충 그림 S5 ). 이는 환자의 면역 체계가 자가 E-섬을 용인할 가능성이 있음을 시사합니다.
환자는 임상 췌도 이식 등록의 규제 지침에 따라 120만 개의 E-췌도 IEQ를 전달하는 경피적 간문맥 이식을 받았습니다.지정된 방문에서 기준선, 4, 8, 12, 16, 20, 24, 36, 48주에 혼합 식사 내성 검사(MMTT)를 통한 내분비 기능 및 당뇨병 특정 매개변수 검사를 수행했으며 그 이후에는 지정된 시점에서 수행했습니다(보충 그림 S6a ).환자의 혈당 조절은 24시간 실시간 연속 포도당 모니터링 시스템(CGM)으로 측정했습니다.
116주 추적 기간 동안 상복부 MRI나 혈청 종양 관련 항원 마커 측정에서 종양 형성이 감지되지 않았습니다. 치료로 인한 부작용은 다음과 같습니다. (1) 4~8주 이내에 일시적인 복부 팽창 및 식욕 부진, 메티오닐트리클로라이드로 완화됨; (2) 회복 가능한 체중 감소 <5%(80kg에서 76kg으로).
세 가지 주요 임상 결과인 혈당 목표, 외인성 인슐린 감소, 공복 및 식사 자극 순환 C-펩타이드/인슐린 수치를 처음 116주 동안 모니터링했습니다(보충 표 S4 , S5 ). 환자의 혈당 조절에 현저한 변화가 이식 후 2주 만에 관찰되었는데, MAGE가 5.50mmol/L에서 3.60mmol/L로 감소하고 TITR이 56.7%에서 77.8%로 급격히 증가했습니다(그림 1h ; 보충 표 S1 ). 같은 기간 동안 범위 초과 시간(TAR)은 기준선에서 55% 감소한 반면, 중증 고혈당(>13.9mM) 및 저혈당(<3.9mM) 사례는 완전히 사라졌습니다(보충 그림 S7a, b 및 표 S1 ). 4주와 12주 사이에 보행 시 평균 포도당 변동이 상당히 감소(5.50mmol/L에서 2.6mmol/L로)(보충 표 S1 )하고 TITR이 꾸준히 증가(81%에서 90%로)하는 현상이 관찰되었습니다(그림 1h ; 보충 그림 S7c–e 및 표 S1 ). 32주 후에 환자의 TITR은 쉽게 99%에 도달했고 그 이후로 유지되었습니다(그림 1h, i ; 보충 표 S1 ). 혈당 변동성의 황금 표준인 MAGE는 5.50mM에서 1.60mM로 감소했습니다(보충 그림 S6d , S7h–l 및 표 S1 ). 중요한 점은 수술 후 116주 동안의 전체 추적 기간 동안 저혈당이나 중증 고혈당이 관찰되지 않았다는 것입니다(보충 그림 S7 및 표 S1 ). 또한 MMTT는 수술 후 혈당 변동성이 안정화되는 추세를 보였으며, 이는 공복 혈당 농도가 안정되고 식후 혈당 농도가 유의미하게 감소(기준선에서 최대 21.3mM 대비 105주차에 최대 9.1mM)하는 데서 나타났습니다(그림 1j ; 보충 표 S5 ). 일관되게, 5점 정맥 주사 혈당 값에서 파생한 곡선 아래 면적(AUC)은 기준선의 40%로 감소했으며(보충 그림 S6b ), CGM에서 얻은 값의 AUC를 통해 확인되었습니다(보충 그림 S6c ). 헤모글로빈 A1c 수치는 6.6%(기준선)에서 5.5%(85주)와 4.6%(113주)로 감소했습니다(그림 1h ; 보충 표 S1 ).
특히, 인슐린 요구량은 11주차 말에 완전히 중단될 때까지 점진적으로 감소했으며(그림 1h ), 경구 항당뇨제는 44주차부터 감량하여 48주차(아카르보스)와 56주차(메트포르민)에 중단했습니다(보충 그림 S6a ).
수술 후 평균 공복 C-펩타이드 수치(0.68 nmol/L)는 수술 전 수치에 비해 3배 증가했습니다(그림 1k ; 보충 표 S5 ). 특히, MMTT로 측정한 C-펩타이드(그림 1k )와 인슐린(그림 1l ) 분비는 수술 전 검사에 비해 유의미하게 증가했으며, 이는 AUC를 통해 확인되었습니다(보충 그림 S6b ).
전체적으로, 우리는 췌도 기능이 손상된 T2D 환자를 위해 자가 E-췌도를 사용한 최초의 인체 조직 대체 요법을 보고합니다. 첫 27개월 데이터는 혈당 조절에서 상당한 개선을 보여주었고, 줄기 세포 유래 췌도 조직이 후기 T2D 환자에서 췌도 기능을 회복할 수 있다는 최초의 증거를 제공했습니다. 이식편은 종양 형성이나 심각한 이식편 관련 부작용 없이 잘 견뎌냈습니다.
사체 췌도 또는 캡슐화된 hPSC 유래 PP를 사용한 선행 임상 시험 10 , 11 과 우리 연구는 췌도 조직 대체가 당뇨병 환자의 효과적인 치료법이라는 격려적인 증거를 제공했습니다. 주목할 점은 hPSC 또는 EnSC에서 췌도 조직을 유도하는 것은 조직 대체 요법에 대한 전례 없는 새로운 공급원을 제공한다는 것입니다. 공통된 개념 증명 목적에도 불구하고 발표된 시험 10 , 11 과 우리 시험 사이에는 몇 가지 차이점이 있습니다. 첫째, EnSC 기반 췌도 재생 시스템은 EnSC가 생체 내에서 종양을 유발하지 않고 12 내배엽 특이적이고 발달적으로 췌장 계통에 더 가깝기 때문에 췌도의 효율적인 대량 생산에 적합하다는 점에서 독특합니다. 둘째, 우리의 파일럿 연구는 T1D 환자보다는 T2D 환자를 선택했는데, 이는 E-췌도의 이식 및 기능을 평가하는 데 자가면역 상태의 간섭을 배제할 뿐만 아니라 췌도 이식의 적응증 범위를 확장했습니다. 이 연구의 한계에 관해서는, 우리는 잔여 내인성 섬이 수술의 혜택을 받고 기능적 개선을 얻었을 가능성을 완전히 배제할 수 없습니다. 따라서 표본 크기를 늘리고 섬 β 세포를 완전히 잃은 T1D 환자를 대상으로 한 추가 시험을 통해 혈당 목표 달성에 있어서 E-섬의 인과적 역할에 대한 확실한 결론을 도출하는 데 도움이 될 것입니다.
향후 연구에서는 줄기세포 유래 췌도의 약력학을 약물로 다루고, 줄기세포 유래 췌도 이식의 적용 범위를 다른 당뇨병 하위 유형으로 확대하고, 면역 억제 없이 당뇨병을 치료할 수 있는 기성품인 "보편적 췌도"를 개발하기 위한 연구가 필요합니다.





 신고
신고 인쇄
인쇄 스크랩
스크랩